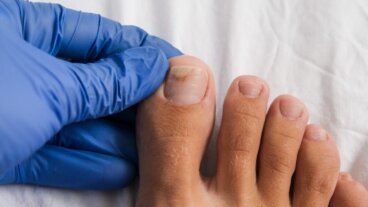
Abekopper: Årsager, symptomer, diagnose og behandling

Skrevet og kontrolleret af læge Leonardo Biolatto
Abekopper er i fokus i aktuelle sundhedsnyheder rundt om i verden. Det er dog ikke en ny sygdom. Faktisk er der blevet rapporteret om tilfælde hos mennesker siden 1970’erne.
Navnet kan virke forvirrende, og de oplysninger, der cirkulerer, skaber også kontroverser. Hvordan overføres den mellem mennesker? Hvorfor er den gået fra at være en sygdom, der er endemisk i Congo, til at skabe udbrud i Europa, Amerika og Australien?
Siden 1980’erne er der blevet flere og flere tilfælde af abekopper. Langsomt, men støt og roligt. Videnskabelige undersøgelser har udfyldt nogle huller om den forårsagende virus, men der er stadig mange spørgsmål.
I denne artikel forklarer vi, hvad vi ved om sygdommen og de allernyeste beviser i forbindelse med et udbrud, som Verdenssundhedsorganisationen (WHO) er meget opmærksom på.
Hvad er abekopper, og hvordan opstod de?
Abekopper hos mennesker blev først opdaget i 1970. Patient nul var et barn i Den Demokratiske Republik Congo, som havde kopperlignende blærer, men som ikke opfyldte alle betingelserne for at blive erklæret for et tilfælde af denne allerede kendte sygdom.
Virussets rejse startede dog ikke der. Faktisk er den første videnskabelige registrering af dette ortopoxvirus hos primater gennem et udbrud hos forsøgsdyr, der blev registreret i 1958.
Antistoffer mod virusset blev senere isoleret hos gnavere og hos aber af forskellige arter med levesteder i Afrika. Der blev dog kun isoleret virus som sådan in vivo to gange i de afrikanske skove. Derfor ved vi ikke, hvad eller hvem der er det egentlige reservoir, dvs. hvor det finder en niche til at overleve og derefter forårsager udbrud.
Derfor er det korrekt at sige, at vi har at gøre med en zoonose. Det er sygdomme, der normalt overføres mellem bestemte dyr, men som lejlighedsvis overføres til mennesker og måske (eller måske ikke) følger en efterfølgende transmissionsvej mellem mennesker.
Denne gruppe af ortopoxvirusser er en del af Poxviridae-familien. Indtil videre er der 4 arter i denne kategori, som kan inficere mennesker:
- Koppevirus: Dette er det klassiske agens, der er kendt i hele verden, og som havde en periode med intens spredning og derefter blev udryddet fra flere lande.
- Vacciniavirus: Dette er den virus, der blev brugt til koppevaccinen. Det var netop denne enorme verdensomspændende vaccinationskampagne, der førte til, at man erklærede, at kopperne var udryddet i forskellige geografiske områder.
- Bovin koppevirus: Dette overføres fra dyr på landet, men dets adfærd er forbundet med fangenskab, og der er også blevet rapporteret om tilfælde hos mennesker fra zoologiske haver og cirkus.
- Ortopoxvirus: Den, som vi i øjeblikket har med at gøre.
Transmission af abekopper
Zoonotisk transmission, dvs. fra dyr til mennesker, er den bedst dokumenterede transmission af denne sygdom. Og de rapporter, vi har, kommer fra Afrika, hvor viralstoffet var næsten begrænset i årtier.
Selv om navnet abekopper antyder, at ikke-menneskelige primater er hovedansvarlige for overførslen til vores art, er sandheden, at forskningen peger på gnavere. Forbruget af gnavere i husholdninger på landet, jagt for at udrydde dem som skadedyr og håndtering af rotter og egern synes at være det første kontaktpunkt for smitte.
I landdistrikterne i Afrika har man således identificeret situationer, der gør det mere sandsynligt, at smitte fra dyr til menneske overføres. F.eks. når folk sover på jorden. Det er også tilfældet, hvis folk spiser vilde dyr (især gnavere).
Andre beviser har udelukket faktorer, der kunne betragtes som risikofaktorer, men som indtil videre ikke er det, f.eks:
- At eje kæledyr.
- Være i kontakt med ekskrementer fra vilde dyr.

Det vigtigste reservoir for denne virus er mus og ikke aber, som navnet synes at indikere.
Interhuman overførsel
Det nuværende udbrud af abekopper skyldes interhuman overførsel, da de geografiske områder, der ligger langt fra hinanden, og de samtidige tilfælde praktisk talt udelukker, at de alle skyldes zoonotiske årsager. Dette er ikke noget nyt, da der siden opdagelsen af sygdommen er blevet rapporteret om infektioner mellem mennesker.
Det mest slående er nu måske antallet af patienter, der udgør transmissionskæden. Selv med personer, hvor selve kæden ikke kan defineres. Vi ved ikke, hvordan de kan være blevet smittet, og alle deres nære kontakter har ingen symptomer.
I tidligere rapporter om udbrud i 1980’erne og 1990’erne nåede transmissionskæden højst op på 8 personer. Det betyder, at ikke mere end dette antal nære kontakter siden patient nul kunne bekræftes med en diagnose.
Dette repræsenterer en meget lav angrebsrate sammenlignet med andre lignende sygdomme. Angrebsfrekvens er et epidemiologisk mål for at bestemme, hvor stor en procentdel af en patients nærmeste kontakter der bliver smittet ved at bo eller opholde sig sammen.
Abekopper havde angrebsfrekvenser på højst 11 %. Sammenlignet med de klassiske kopper er dette ubetydeligt, da sidstnævnte har en angrebsrate på 80 %.
Smitteveje for abekopper
Selv om tæt kontakt antages at være smittevejen, er den mest specifikke kendte smittevej, at den mellemfolkelige smitte kommer fra luftbårne og kutane veje gennem respiratoriske dråber og fra hud til hud.
Som ved almindelige kopper smitter hudlæsioner og de væsker, der udskilles fra dem. Virusset kan bevæge sig gennem sekret og nå andre genstande og andre mennesker.
Den lave angrebsfrekvens og manglen på oplysninger om transmissionskæden i det nuværende udbrud gør det ikke muligt at definere de omstændigheder, der gør smitten effektiv, mere klart. Hvis det er en almindelig luftbåren smittevej (ligesom influenza), hvorfor er der så ikke flere nære kontakter til bekræftede patienter, der bliver smittet?
Et særligt spørgsmål, der diskuteres i forbindelse med det nuværende udbrud, er seksuel overførsel. Det ser ud til at være en almindelig faktor blandt patienter, hos hvem smittekæden er blevet etableret. Men der er ingen bekræftelse, og nogle specialister mener ikke engang, at det er en mulig smittevej.
Find ud af mere: Hvorfor ændrer vira sig? Få svaret her
Hvad er symptomerne?
Inkubationstiden for abekopper, dvs. tiden fra kontakt med virus til de første symptomer opstår, varierer fra 6 til 16 dage. Det er ikke helt klart, men 2 uger synes at være gennemsnittet.
De klassiske tilfælde begynder med feber, der kan vare fra 1 til 4 dage. Den ledsages af de klassiske febrile symptomer med hovedpine, træthed, muskelsmerter og søvnighed.
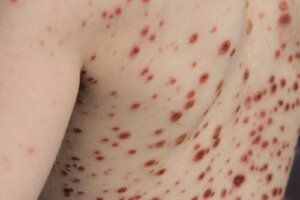
Derefter begynder det karakteristiske dermale udbrud. Det, der hidtil er blevet beskrevet, er en centrifugal præsentation (startende på kropsstammen og fortsættende til ekstremiteterne) af pletter og papler sammen med vesikler (med væskeindhold) og pustler (med pusindhold), der udvikler sig til skorper.
Betændelse i lymfeknuderne er berygtet ved abekopper. Dette adskiller den fra de klassiske kopper, som næsten ikke har nogen lymfadenopati.
Sværhedsgraden er for det meste mild, men den kan være dødelig i nogle få tilfælde (1 % er dødeligheden i Afrika). Svære tilfælde kompliceres ofte af opkastning og diarré, hjernebetændelse og lungebetændelse. Nogle patienter opnår sepsis og dør af multiorgansvigt.
Der er en reduktion af patientens immunforsvar, hvilket kan begunstige superinfektion med bakterier. Dette er en af forklaringerne på de dødelige tilfælde, der når til sepsis.
Der er en særlig situation hos gravide kvinder, fordi de har en højere dødelighed og komplikationsrate, når de er inficeret med abekopper. Ligeledes har nogle rapporter bekræftet, at der er vertikal overførsel, dvs. fra moderen til fosteret.
Identificering af tilfælde
Gennem hele historien, fra 1970 til i dag, har der været forskellige definitioner af formodede tilfælde af kopper. Dette sker for at identificere patienterne og isolere dem.
Hvert land fastsætter de advarselstegn, som vi skal være opmærksomme på, og hvilke karakteristika sundhedssystemerne skal reagere på. Men generelt er man enige om, at en person er mistænkt for at have sygdommen, når vedkommende har feber og blæreudslæt samt mindst et af følgende tre symptomer:
- Udslæt på håndfladerne eller fodsålerne.
- Betændelse i lymfeknuderne.
- Episoder med forhøjet kropstemperatur, før udslættet opstår.
Dette er naturligvis ud over undersøgelsen af, hvem der var sammen med den mistænkte patient. Hvis personen med disse tegn har været i tæt kontakt med en person, der allerede har en bekræftet diagnose, øges chancen for at være positiv.
Hvordan bekræftes diagnosen?
Det første skridt i den diagnostiske vej til abekopper begynder med mistanke. Der er tale om de mistænkte tilfælde i henhold til den ovenstående definition.
Disse patienter skal isoleres, og der skal iværksættes testning for at afgøre, om sygdommen kan bekræftes eller ej. Dette er ikke nogen hurtig løsning, da det endnu ikke er et viralt agens, der kan testes i vid udstrækning på verdensplan.
Flere steder har man valgt at anmode om IgG- og IgM-immunoglobulinprøver mod ortopoxvirus. Det er ikke specifikt, men hvis resultatet er positivt, kan man fortsætte med bekræftelsen, mens man afventer mere specifikke resultater, som kan tage noget tid.
Disse specifikke test afhænger af tilgængeligheden på de enkelte sundhedscentre:
- Polymerasekædereaktion (PCR).
- Immunhistokemi.
- Elektronmikroskopi.
Disse metoder er kun tilgængelige på nogle centre, der modtager prøver fra andre geografiske områder. Derfor er forsinkelse næsten uundgåelig, og man bør isolere mistænkte personer, mens man venter.
Immunglobuliner, PCR og immunohistokemi kræver en blodprøve fra patienten. Elektronmikroskopi anvendes til at foretage en visuel analyse af sekret, hvis der indsamles sekret, som skal sendes til laboratoriet.
Hvad er behandlingen af abekopper?
Kopper har ingen konkret og specifik behandling. Ligesom mange virale sygdomme findes der ikke noget bestemt lægemiddel, der kan blokere eller ophæve patogenets replikation.
Derfor er det, som eksperterne anbefaler, isolation med understøttende foranstaltninger. Nogle patienter med milde tilfælde har ikke brug for nogen farmakologisk tilgang. Andre er alvorlige nok til at retfærdiggøre forsøg med antivirale midler.
Der er ikke tilstrækkelig dokumentation for, at antivirale midler er effektive til at reducere komplikationer. De er forbeholdt anvendelse efter behandlerens skøn hos dem, der forværres eller er i risiko for at dø, dvs. hos 1 % af de diagnosticerede.
Brincidofovir og tecovirimat er navnene på to lægemidler, der er blevet undersøgt til behandling af ortopoxvirus. De har fungeret mere i forbindelse med klassiske kopper, så i dag udgør de den bedste mulighed for udbruddet.
På den anden side fortjener komplikationer deres eget behandlingsskema. Bakterielle superinfektioner, som er almindelige i alvorlige tilfælde, behandles med antibiotika, der er specifikke for den mikroorganisme, som er blevet identificeret.
Ved lungebetændelse eller hjernebetændelse, der opstår som en komplikation under indlæggelsen, kan det medicinske team beslutte at give livshjælp. Dette sker ved hjælp af assisteret ventilation, hvis patientens tilstand berettiger det. Det er ikke meget anderledes end det, der gøres ved lignende tilstande forårsaget af andre ætiologier.
Livshjælp under indlæggelse er nødvendig, når f.eks. luftvejene er påvirket.
Udskrivelse af patienter
Der er stadig diskussion om, hvornår patienter skal udskrives. De fleste kommer sig tilfredsstillende og får ingen følgevirkninger. Men det er spørgsmålet om overførsel mellem mennesker, der afgør spørgsmålet om, hvornår isolationen skal ophøre.
I tidligere udbrud, både i Afrika og i nogle tilfælde i USA og Storbritannien, blev det foreslået at udskrive patienterne, når læsionerne var forsvundet. Det antages, at personen på det tidspunkt ikke længere er smitsom. Dette er tilfældet med klassiske kopper.
Man har imidlertid fundet frem til, at nogle patienter har positive PCR-resultater i luftvejene op til 3 uger efter, at skorperne er forsvundet. Det er ikke bekræftet, om dette er ensbetydende med smittefare.
Også fra tidligere rapporter ved vi, at der er patienter, som har lymfadenopati og hududslæt igen efter samleje, efter at de er blevet udskrevet. Dette giver mistanke om en forankring af virus i kønsorganerne, hvilket kan forlænge transmissionen ad den vej længe efter.
Findes der en vaccine?
Den amerikanske lægemiddelstyrelse (FDA) godkendte en vaccine kaldet JYNNEOS i 2019. Denne immunisering ville være effektiv mod både kopper og abekopper.
Det er ikke blevet besluttet, at den skal være tilgængelig til markedsføring, selv om indikationen for risikopopulationer er ved at blive undersøgt. Personer, der bor i endemiske områder, nære kontakter til bekræftede tilfælde og arbejdstagere, der er udsat for dyr, der er kendt for at være reservoirer, kunne være modtagere.
Vaccinationsskemaet her er to doser, der bør gives med en måneds mellemrum. Men vi understreger, at der stadig ikke er nogen godkendelse af, at den skal indgå i de officielle vaccinationsprogrammer eller anvendes under de nuværende udbrud.
EU-landene arbejder imidlertid på de juridiske spørgsmål om at erhverve doser og give dem til nære kontakter, idet de antager, at det kan skabe en beskyttelse, der kan standse spredningen i udsatte grupper.
Man ved, at personer, der er vaccineret med den klassiske koppevaccine, har en fordel. Den beskyttelse, som en sådan immunisering mod kopper giver, anslås at være 85 %, hvilket anses for mere end acceptabelt.
Faktisk skyldes en del af det unikke ved dette nuværende udbrud, at der er færre personer, der er vaccineret mod kopper, på grund af de geografiske områder, der er blevet erklæret udryddet. Dette ville have øget befolkningernes følsomhed over for virus af samme familie.
Det nuværende udbrud: Hvad vi ved
Det nuværende udbrud af abekopper anses for at være startet den 7. maj 2022, da Det Forenede Kongerige indberettede et tilfælde fra Afrika. På trods heraf foreslår nogle epidemiologer at forlænge perioden fra 2021, da USA rapporterede et lille antal tilfælde på sit territorium.
Fra begyndelsen af maj til i dag er der mere end 250 bekræftede tilfælde uden for Afrika. Det drejer sig om 16 lande.
Det er en situation uden fortilfælde, især med mere end 100 mistænkte personer i isolation, der afventer bekræftelse. Verdenssundhedsorganisationen har erklæret udbruddet, men præciserer, at det er muligt at kontrollere det. Ud over at risikoen hos den almindelige befolkning er lav.
I Danmark er der 189 bekræftede tilfælde, Nordirland fik sin første positive patient den 26. maj, og det samme gælder Wales. Australien registrerede det første tilfælde i Melbourne hos en person, der vendte tilbage fra Det Forenede Kongerige.
Massachusetts-sagen fra Montreal udløste en intensiv eftersøgning efter mistænkte i Canada, hvor 13 personer blev isoleret. Samtidig har USA hævet anbefalingen om varsling i forbindelse med internationale rejser, således at der træffes ekstreme forholdsregler for at forhindre overførsel mellem mennesker.
Hvad kan vi gøre?
Forebyggelsesforanstaltningerne for at undgå at blive smittet med abekopper har at gøre med nogle generelle retningslinjer og med restriktioner, der skal anvendes under særlige omstændigheder. Blandt de førstnævnte kan nævnes følgende:
- Hyppig håndvask.
- Håndtering af animalske fødevarer med maksimal hygiejne.
- Køb kun fødevarer af animalsk oprindelse på autoriserede steder og virksomheder.
- Når du rejser, skal du bo på steder, der er certificeret af sundhedsmyndighederne, og hvor den skadedyrsbekæmpelse, der er udført i lokalerne, er tydelig.
- Når du besøger naturreservater, f.eks. forlystelsesparker eller zoologiske haver, må du ikke komme i kontakt med dyr og bør holde en sikker afstand fra dem.
Hvad angår særlige restriktioner, skal det understreges, at hvis man har været i kontakt med syge personer eller rejst til et geografisk område med et udbrud i de sidste 14-21 dage, bør man konsultere sundhedsmyndighederne. Der bør foretages isolering og screening med supplerende metoder.
Selvisolation indtil konsultation bør være reglen for personer med disse karakteristika. Tilsvarende bør familiemedlemmer og samlevere følge den samme procedure, indtil der foreligger en positiv eller negativ bekræftelse.
Det er vigtigt ikke at gå i panik. Som WHO har gjort det klart, befinder vi os endnu ikke i en pandemisk situation, og der er ingen øget risiko hos den almindelige befolkning, så generelle hygiejneforanstaltninger, tidlig identifikation af symptomer og konsultation i tilfælde af tvivl er tilstrækkeligt.
Abekopper er i fokus i aktuelle sundhedsnyheder rundt om i verden. Det er dog ikke en ny sygdom. Faktisk er der blevet rapporteret om tilfælde hos mennesker siden 1970’erne.
Navnet kan virke forvirrende, og de oplysninger, der cirkulerer, skaber også kontroverser. Hvordan overføres den mellem mennesker? Hvorfor er den gået fra at være en sygdom, der er endemisk i Congo, til at skabe udbrud i Europa, Amerika og Australien?
Siden 1980’erne er der blevet flere og flere tilfælde af abekopper. Langsomt, men støt og roligt. Videnskabelige undersøgelser har udfyldt nogle huller om den forårsagende virus, men der er stadig mange spørgsmål.
I denne artikel forklarer vi, hvad vi ved om sygdommen og de allernyeste beviser i forbindelse med et udbrud, som Verdenssundhedsorganisationen (WHO) er meget opmærksom på.
Hvad er abekopper, og hvordan opstod de?
Abekopper hos mennesker blev først opdaget i 1970. Patient nul var et barn i Den Demokratiske Republik Congo, som havde kopperlignende blærer, men som ikke opfyldte alle betingelserne for at blive erklæret for et tilfælde af denne allerede kendte sygdom.
Virussets rejse startede dog ikke der. Faktisk er den første videnskabelige registrering af dette ortopoxvirus hos primater gennem et udbrud hos forsøgsdyr, der blev registreret i 1958.
Antistoffer mod virusset blev senere isoleret hos gnavere og hos aber af forskellige arter med levesteder i Afrika. Der blev dog kun isoleret virus som sådan in vivo to gange i de afrikanske skove. Derfor ved vi ikke, hvad eller hvem der er det egentlige reservoir, dvs. hvor det finder en niche til at overleve og derefter forårsager udbrud.
Derfor er det korrekt at sige, at vi har at gøre med en zoonose. Det er sygdomme, der normalt overføres mellem bestemte dyr, men som lejlighedsvis overføres til mennesker og måske (eller måske ikke) følger en efterfølgende transmissionsvej mellem mennesker.
Denne gruppe af ortopoxvirusser er en del af Poxviridae-familien. Indtil videre er der 4 arter i denne kategori, som kan inficere mennesker:
- Koppevirus: Dette er det klassiske agens, der er kendt i hele verden, og som havde en periode med intens spredning og derefter blev udryddet fra flere lande.
- Vacciniavirus: Dette er den virus, der blev brugt til koppevaccinen. Det var netop denne enorme verdensomspændende vaccinationskampagne, der førte til, at man erklærede, at kopperne var udryddet i forskellige geografiske områder.
- Bovin koppevirus: Dette overføres fra dyr på landet, men dets adfærd er forbundet med fangenskab, og der er også blevet rapporteret om tilfælde hos mennesker fra zoologiske haver og cirkus.
- Ortopoxvirus: Den, som vi i øjeblikket har med at gøre.
Transmission af abekopper
Zoonotisk transmission, dvs. fra dyr til mennesker, er den bedst dokumenterede transmission af denne sygdom. Og de rapporter, vi har, kommer fra Afrika, hvor viralstoffet var næsten begrænset i årtier.
Selv om navnet abekopper antyder, at ikke-menneskelige primater er hovedansvarlige for overførslen til vores art, er sandheden, at forskningen peger på gnavere. Forbruget af gnavere i husholdninger på landet, jagt for at udrydde dem som skadedyr og håndtering af rotter og egern synes at være det første kontaktpunkt for smitte.
I landdistrikterne i Afrika har man således identificeret situationer, der gør det mere sandsynligt, at smitte fra dyr til menneske overføres. F.eks. når folk sover på jorden. Det er også tilfældet, hvis folk spiser vilde dyr (især gnavere).
Andre beviser har udelukket faktorer, der kunne betragtes som risikofaktorer, men som indtil videre ikke er det, f.eks:
- At eje kæledyr.
- Være i kontakt med ekskrementer fra vilde dyr.

Det vigtigste reservoir for denne virus er mus og ikke aber, som navnet synes at indikere.
Interhuman overførsel
Det nuværende udbrud af abekopper skyldes interhuman overførsel, da de geografiske områder, der ligger langt fra hinanden, og de samtidige tilfælde praktisk talt udelukker, at de alle skyldes zoonotiske årsager. Dette er ikke noget nyt, da der siden opdagelsen af sygdommen er blevet rapporteret om infektioner mellem mennesker.
Det mest slående er nu måske antallet af patienter, der udgør transmissionskæden. Selv med personer, hvor selve kæden ikke kan defineres. Vi ved ikke, hvordan de kan være blevet smittet, og alle deres nære kontakter har ingen symptomer.
I tidligere rapporter om udbrud i 1980’erne og 1990’erne nåede transmissionskæden højst op på 8 personer. Det betyder, at ikke mere end dette antal nære kontakter siden patient nul kunne bekræftes med en diagnose.
Dette repræsenterer en meget lav angrebsrate sammenlignet med andre lignende sygdomme. Angrebsfrekvens er et epidemiologisk mål for at bestemme, hvor stor en procentdel af en patients nærmeste kontakter der bliver smittet ved at bo eller opholde sig sammen.
Abekopper havde angrebsfrekvenser på højst 11 %. Sammenlignet med de klassiske kopper er dette ubetydeligt, da sidstnævnte har en angrebsrate på 80 %.
Smitteveje for abekopper
Selv om tæt kontakt antages at være smittevejen, er den mest specifikke kendte smittevej, at den mellemfolkelige smitte kommer fra luftbårne og kutane veje gennem respiratoriske dråber og fra hud til hud.
Som ved almindelige kopper smitter hudlæsioner og de væsker, der udskilles fra dem. Virusset kan bevæge sig gennem sekret og nå andre genstande og andre mennesker.
Den lave angrebsfrekvens og manglen på oplysninger om transmissionskæden i det nuværende udbrud gør det ikke muligt at definere de omstændigheder, der gør smitten effektiv, mere klart. Hvis det er en almindelig luftbåren smittevej (ligesom influenza), hvorfor er der så ikke flere nære kontakter til bekræftede patienter, der bliver smittet?
Et særligt spørgsmål, der diskuteres i forbindelse med det nuværende udbrud, er seksuel overførsel. Det ser ud til at være en almindelig faktor blandt patienter, hos hvem smittekæden er blevet etableret. Men der er ingen bekræftelse, og nogle specialister mener ikke engang, at det er en mulig smittevej.
Find ud af mere: Hvorfor ændrer vira sig? Få svaret her
Hvad er symptomerne?
Inkubationstiden for abekopper, dvs. tiden fra kontakt med virus til de første symptomer opstår, varierer fra 6 til 16 dage. Det er ikke helt klart, men 2 uger synes at være gennemsnittet.
De klassiske tilfælde begynder med feber, der kan vare fra 1 til 4 dage. Den ledsages af de klassiske febrile symptomer med hovedpine, træthed, muskelsmerter og søvnighed.
Derefter begynder det karakteristiske dermale udbrud. Det, der hidtil er blevet beskrevet, er en centrifugal præsentation (startende på kropsstammen og fortsættende til ekstremiteterne) af pletter og papler sammen med vesikler (med væskeindhold) og pustler (med pusindhold), der udvikler sig til skorper.
Betændelse i lymfeknuderne er berygtet ved abekopper. Dette adskiller den fra de klassiske kopper, som næsten ikke har nogen lymfadenopati.
Sværhedsgraden er for det meste mild, men den kan være dødelig i nogle få tilfælde (1 % er dødeligheden i Afrika). Svære tilfælde kompliceres ofte af opkastning og diarré, hjernebetændelse og lungebetændelse. Nogle patienter opnår sepsis og dør af multiorgansvigt.
Der er en reduktion af patientens immunforsvar, hvilket kan begunstige superinfektion med bakterier. Dette er en af forklaringerne på de dødelige tilfælde, der når til sepsis.
Der er en særlig situation hos gravide kvinder, fordi de har en højere dødelighed og komplikationsrate, når de er inficeret med abekopper. Ligeledes har nogle rapporter bekræftet, at der er vertikal overførsel, dvs. fra moderen til fosteret.
Identificering af tilfælde
Gennem hele historien, fra 1970 til i dag, har der været forskellige definitioner af formodede tilfælde af kopper. Dette sker for at identificere patienterne og isolere dem.
Hvert land fastsætter de advarselstegn, som vi skal være opmærksomme på, og hvilke karakteristika sundhedssystemerne skal reagere på. Men generelt er man enige om, at en person er mistænkt for at have sygdommen, når vedkommende har feber og blæreudslæt samt mindst et af følgende tre symptomer:
- Udslæt på håndfladerne eller fodsålerne.
- Betændelse i lymfeknuderne.
- Episoder med forhøjet kropstemperatur, før udslættet opstår.
Dette er naturligvis ud over undersøgelsen af, hvem der var sammen med den mistænkte patient. Hvis personen med disse tegn har været i tæt kontakt med en person, der allerede har en bekræftet diagnose, øges chancen for at være positiv.
Hvordan bekræftes diagnosen?
Det første skridt i den diagnostiske vej til abekopper begynder med mistanke. Der er tale om de mistænkte tilfælde i henhold til den ovenstående definition.
Disse patienter skal isoleres, og der skal iværksættes testning for at afgøre, om sygdommen kan bekræftes eller ej. Dette er ikke nogen hurtig løsning, da det endnu ikke er et viralt agens, der kan testes i vid udstrækning på verdensplan.
Flere steder har man valgt at anmode om IgG- og IgM-immunoglobulinprøver mod ortopoxvirus. Det er ikke specifikt, men hvis resultatet er positivt, kan man fortsætte med bekræftelsen, mens man afventer mere specifikke resultater, som kan tage noget tid.
Disse specifikke test afhænger af tilgængeligheden på de enkelte sundhedscentre:
- Polymerasekædereaktion (PCR).
- Immunhistokemi.
- Elektronmikroskopi.
Disse metoder er kun tilgængelige på nogle centre, der modtager prøver fra andre geografiske områder. Derfor er forsinkelse næsten uundgåelig, og man bør isolere mistænkte personer, mens man venter.
Immunglobuliner, PCR og immunohistokemi kræver en blodprøve fra patienten. Elektronmikroskopi anvendes til at foretage en visuel analyse af sekret, hvis der indsamles sekret, som skal sendes til laboratoriet.
Hvad er behandlingen af abekopper?
Kopper har ingen konkret og specifik behandling. Ligesom mange virale sygdomme findes der ikke noget bestemt lægemiddel, der kan blokere eller ophæve patogenets replikation.
Derfor er det, som eksperterne anbefaler, isolation med understøttende foranstaltninger. Nogle patienter med milde tilfælde har ikke brug for nogen farmakologisk tilgang. Andre er alvorlige nok til at retfærdiggøre forsøg med antivirale midler.
Der er ikke tilstrækkelig dokumentation for, at antivirale midler er effektive til at reducere komplikationer. De er forbeholdt anvendelse efter behandlerens skøn hos dem, der forværres eller er i risiko for at dø, dvs. hos 1 % af de diagnosticerede.
Brincidofovir og tecovirimat er navnene på to lægemidler, der er blevet undersøgt til behandling af ortopoxvirus. De har fungeret mere i forbindelse med klassiske kopper, så i dag udgør de den bedste mulighed for udbruddet.
På den anden side fortjener komplikationer deres eget behandlingsskema. Bakterielle superinfektioner, som er almindelige i alvorlige tilfælde, behandles med antibiotika, der er specifikke for den mikroorganisme, som er blevet identificeret.
Ved lungebetændelse eller hjernebetændelse, der opstår som en komplikation under indlæggelsen, kan det medicinske team beslutte at give livshjælp. Dette sker ved hjælp af assisteret ventilation, hvis patientens tilstand berettiger det. Det er ikke meget anderledes end det, der gøres ved lignende tilstande forårsaget af andre ætiologier.

Livshjælp under indlæggelse er nødvendig, når f.eks. luftvejene er påvirket.
Udskrivelse af patienter
Der er stadig diskussion om, hvornår patienter skal udskrives. De fleste kommer sig tilfredsstillende og får ingen følgevirkninger. Men det er spørgsmålet om overførsel mellem mennesker, der afgør spørgsmålet om, hvornår isolationen skal ophøre.
I tidligere udbrud, både i Afrika og i nogle tilfælde i USA og Storbritannien, blev det foreslået at udskrive patienterne, når læsionerne var forsvundet. Det antages, at personen på det tidspunkt ikke længere er smitsom. Dette er tilfældet med klassiske kopper.
Man har imidlertid fundet frem til, at nogle patienter har positive PCR-resultater i luftvejene op til 3 uger efter, at skorperne er forsvundet. Det er ikke bekræftet, om dette er ensbetydende med smittefare.
Også fra tidligere rapporter ved vi, at der er patienter, som har lymfadenopati og hududslæt igen efter samleje, efter at de er blevet udskrevet. Dette giver mistanke om en forankring af virus i kønsorganerne, hvilket kan forlænge transmissionen ad den vej længe efter.
Findes der en vaccine?
Den amerikanske lægemiddelstyrelse (FDA) godkendte en vaccine kaldet JYNNEOS i 2019. Denne immunisering ville være effektiv mod både kopper og abekopper.
Det er ikke blevet besluttet, at den skal være tilgængelig til markedsføring, selv om indikationen for risikopopulationer er ved at blive undersøgt. Personer, der bor i endemiske områder, nære kontakter til bekræftede tilfælde og arbejdstagere, der er udsat for dyr, der er kendt for at være reservoirer, kunne være modtagere.
Vaccinationsskemaet her er to doser, der bør gives med en måneds mellemrum. Men vi understreger, at der stadig ikke er nogen godkendelse af, at den skal indgå i de officielle vaccinationsprogrammer eller anvendes under de nuværende udbrud.
EU-landene arbejder imidlertid på de juridiske spørgsmål om at erhverve doser og give dem til nære kontakter, idet de antager, at det kan skabe en beskyttelse, der kan standse spredningen i udsatte grupper.
Man ved, at personer, der er vaccineret med den klassiske koppevaccine, har en fordel. Den beskyttelse, som en sådan immunisering mod kopper giver, anslås at være 85 %, hvilket anses for mere end acceptabelt.
Faktisk skyldes en del af det unikke ved dette nuværende udbrud, at der er færre personer, der er vaccineret mod kopper, på grund af de geografiske områder, der er blevet erklæret udryddet. Dette ville have øget befolkningernes følsomhed over for virus af samme familie.
Det nuværende udbrud: Hvad vi ved
Det nuværende udbrud af abekopper anses for at være startet den 7. maj 2022, da Det Forenede Kongerige indberettede et tilfælde fra Afrika. På trods heraf foreslår nogle epidemiologer at forlænge perioden fra 2021, da USA rapporterede et lille antal tilfælde på sit territorium.
Fra begyndelsen af maj til i dag er der mere end 250 bekræftede tilfælde uden for Afrika. Det drejer sig om 16 lande.
Det er en situation uden fortilfælde, især med mere end 100 mistænkte personer i isolation, der afventer bekræftelse. Verdenssundhedsorganisationen har erklæret udbruddet, men præciserer, at det er muligt at kontrollere det. Ud over at risikoen hos den almindelige befolkning er lav.
I Danmark er der 189 bekræftede tilfælde, Nordirland fik sin første positive patient den 26. maj, og det samme gælder Wales. Australien registrerede det første tilfælde i Melbourne hos en person, der vendte tilbage fra Det Forenede Kongerige.
Massachusetts-sagen fra Montreal udløste en intensiv eftersøgning efter mistænkte i Canada, hvor 13 personer blev isoleret. Samtidig har USA hævet anbefalingen om varsling i forbindelse med internationale rejser, således at der træffes ekstreme forholdsregler for at forhindre overførsel mellem mennesker.
Hvad kan vi gøre?
Forebyggelsesforanstaltningerne for at undgå at blive smittet med abekopper har at gøre med nogle generelle retningslinjer og med restriktioner, der skal anvendes under særlige omstændigheder. Blandt de førstnævnte kan nævnes følgende:
- Hyppig håndvask.
- Håndtering af animalske fødevarer med maksimal hygiejne.
- Køb kun fødevarer af animalsk oprindelse på autoriserede steder og virksomheder.
- Når du rejser, skal du bo på steder, der er certificeret af sundhedsmyndighederne, og hvor den skadedyrsbekæmpelse, der er udført i lokalerne, er tydelig.
- Når du besøger naturreservater, f.eks. forlystelsesparker eller zoologiske haver, må du ikke komme i kontakt med dyr og bør holde en sikker afstand fra dem.
Hvad angår særlige restriktioner, skal det understreges, at hvis man har været i kontakt med syge personer eller rejst til et geografisk område med et udbrud i de sidste 14-21 dage, bør man konsultere sundhedsmyndighederne. Der bør foretages isolering og screening med supplerende metoder.
Selvisolation indtil konsultation bør være reglen for personer med disse karakteristika. Tilsvarende bør familiemedlemmer og samlevere følge den samme procedure, indtil der foreligger en positiv eller negativ bekræftelse.
Det er vigtigt ikke at gå i panik. Som WHO har gjort det klart, befinder vi os endnu ikke i en pandemisk situation, og der er ingen øget risiko hos den almindelige befolkning, så generelle hygiejneforanstaltninger, tidlig identifikation af symptomer og konsultation i tilfælde af tvivl er tilstrækkeligt.
Alle citerede kilder blev grundigt gennemgået af vores team for at sikre deres kvalitet, pålidelighed, aktualitet og validitet. Bibliografien i denne artikel blev betragtet som pålidelig og af akademisk eller videnskabelig nøjagtighed.
- Marennikova SS, Seluhina EM, Malceva NM, Ladnyj ID. Poxviruses isolated from clinically ill and asymptomalically infected monkeys and a chimpanzee. Bulletin of the World Health Organization. 1972;46(5):613–20. pmid:4340220.
- Doty JB, Malekani JM, Kalemba LN, Stanley WT, Monroe BP, Nakazawa YU, et al. Assessing Monkeypox Virus Prevalence in Small Mammals at the Human-Animal Interface in the Democratic Republic of the Congo. Viruses. 2017;9(10):03. pmid:28972544.
- Ogoina D, Iroezindu M, James HI, Oladokun R, Yinka-Ogunleye A, Wakama P, Otike-Odibi B, Usman LM, Obazee E, Aruna O, Ihekweazu C. Clinical course and outcome of human monkeypox in Nigeria. Clinical Infectious Diseases. 2020 Oct 15;71(8):e210-4.
- Coto, C. E. (2009). Virus sin fronteras: el caso del virus cow pox, agente de la viruela bovina. Química Viva, 8(2), 57-63.
- Reynolds MG, Carroll DS, Olson VA, Hughes C, Galley J, Likos A, et al. A silent enzootic of an orthopoxvirus in Ghana, West Africa: Evidence for multi-species involvement in the absence of widespread human disease. American Journal of Tropical Medicine and Hygiene. 2010;82(4):746–54. pmid:20348530
- Mbala PK, Huggins JW, Riu-Rovira T, Ahuka SM, Mulembakani P, Rimoin AW, et al. Maternal and Fetal Outcomes among Pregnant Women with Human Monkeypox Infection in the Democratic Republic of Congo. Journal of Infectious Diseases. 2017;216(7):824–8. pmid:29029147.
- Jezek Z, Grab B, Szczeniowski M, Paluku KM, Mutombo M. Clinico-epidemiological features of monkeypox patients with an animal or human source of infection. Bulletin of the World Health Organization. 1988;66(4):459–64. pmid:2844428
- Nolen LD, Osadebe L, Katomba J, Likofata J, Mukadi D, Monroe B, Doty J, Hughes CM, Kabamba J, Malekani J, Bomponda PL, Lokota JI, Balilo MP, Likafi T, Lushima RS, Ilunga BK, Nkawa F, Pukuta E, Karhemere S, Tamfum JJ, Nguete B, Wemakoy EO, McCollum AM, Reynolds MG. Extended Human-to-Human Transmission during a Monkeypox Outbreak in the Democratic Republic of the Congo. Emerg Infect Dis. 2016 Jun;22(6):1014-21. doi: 10.3201/eid2206.150579. Erratum in: Emerg Infect Dis. 2016 Oct;22(10 ): PMID: 27191380; PMCID: PMC4880088.
- Reynolds, M. G., Yorita, K. L., Kuehnert, M. J., Davidson, W. B., Huhn, G. D., Holman, R. C., & Damon, I. K. (2006). Clinical manifestations of human monkeypox influenced by route of infection. The Journal of infectious diseases, 194(6), 773-780.
- Mwanbal, P. T., Tshioko, K. F., Moudi, A., Mukinda, V., Mwema, G. N., Messinger, D., … & Esposito, J. J. (1997). Casos humanos de viruela de los monos en Kasai Oriental, Zaire (1996-1997). Eurosurveillance, 2(5), 33-35.
- Chittick G, Morrison M, Brundage T, Nichols WG. Short-term clinical safety profile of brincidofovir: A favorable benefit–risk proposition in the treatment of smallpox. Antiviral research. 2017 Jul 1;143:269-77.
- Grosenbach DW, Honeychurch K, Rose EA, Chinsangaram J, Frimm A, Maiti B, Lovejoy C, Meara I, Long P, Hruby DE. Oral tecovirimat for the treatment of smallpox. New England Journal of Medicine. 2018 Jul 5;379(1):44-53.
- Reynolds MG, Davidson WB, Curns AT, Conover CS, Huhn G, Davis JP, et al. Spectrum of infection and risk factors for human monkeypox, United States, 2003. Emerging Infectious Diseases. 2007;13(9):1332–9. pmid:18252104.
- Panning M, Asper M, Kramme S, Schmitz H, Drosten C. Rapid detection and differentiation of human pathogenic orthopox viruses by a fluorescence resonance energy transfer real-time PCR assay. Clinical Chemistry. 2004;50(4):702–8. pmid:14962998.
Denne tekst er kun til informationsformål og erstatter ikke konsultation med en professionel. Hvis du er i tvivl, så konsulter din specialist.